
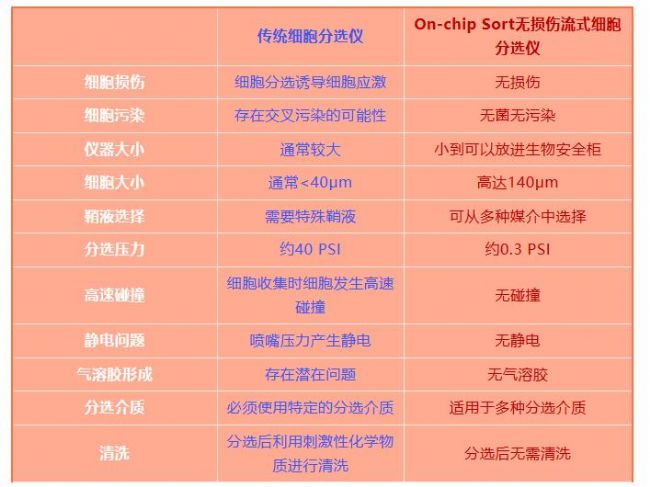
近年来,研究人员注意到细胞分选后细胞的变化,如形态学变化、细胞生长延迟、细胞活力降低以及基因表达的改变。这是因为传统的细胞分选技术是空气喷射法,这种分选方式很容易引发细胞分选后的细胞应激。如何降低或者避免这种分选后细胞应激现象的产生成为细胞分选的一大挑战。
On-chip Sort 无损伤流式细胞分选仪是世界上首个利用微流控芯片技术进行细胞分选的仪器。这种技术很好的解决了传统细胞分选仪可能出现的细胞损伤和细胞污染等问题。
On-chip Sort 技术的核心是使用一次性的小型微流控芯片,样品和鞘液分别装入芯片上的样品池和鞘液池。传统的细胞分选仪需要特定的鞘液,而On-chip Sort 可以选择适合细胞的任何鞘液,例如培养基、淡水、海水和油等。
On-chip Sort 无损伤流式细胞分选仪通过“流动移位”机制进行,当检测到目标细胞接近分选区域时,通过空气加压产生短的液体脉冲,将目标细胞转移到收集池。而非目标细胞则继续流动进入废液池。这种分选的方法不涉及高压、喷嘴产生静电和细胞高速碰撞等问题,所以可以实现细胞无损伤分选。
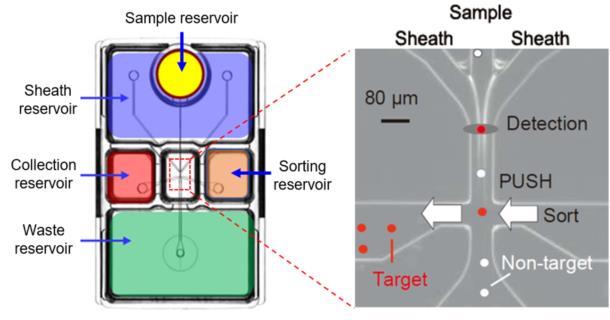
在进行细胞分析和分选的过程中,所有的液体(包括样品、鞘液和废液)都保留在芯片内,并不需要外部的储液装置。液体流动通道和储液池中的液体都不会与仪器本身直接接触,并且芯片也是无菌的,因此不会产生样本间的污染和样本与仪器之间的污染。
基于空气喷射和反应池混合动力为原理的传统细胞分选仪在进行细胞分选时的多个步骤都很容易对细胞造成破坏或诱导细胞产生应激反应。而On-chip Sort 无损伤流式细胞分选仪因为微流控芯片的设计,去除了一些可能会损伤细胞的步骤,并且关键还在于其分选压力比传统细胞分选仪低100多倍,因此可以进行更加温和的细胞分选,对细胞无损伤。
On-chip Sort 被用于多种细胞类型的细胞分选,特别是一些非常“脆弱”的不能用其他细胞分选仪器分选的细胞。包括神经细胞、iPS衍生细胞、转染细胞、心肌细胞、肝细胞、精子细胞和脂肪细胞等。接下来,跟大家分享一些利用On-chip Sort 进行细胞分选的结果。

01. 分选对细胞生长的影响
为了比较传统的细胞分选仪(空气喷射法)和On-chip Sort(微流控分选法)对稳定的HeLa细胞分选后的影响,分别用两种细胞分选仪对100个HeLa细胞进行分选。分选后,将分选的细胞收集起来在96孔板上进行培养,并且每天对其进行细胞计数。
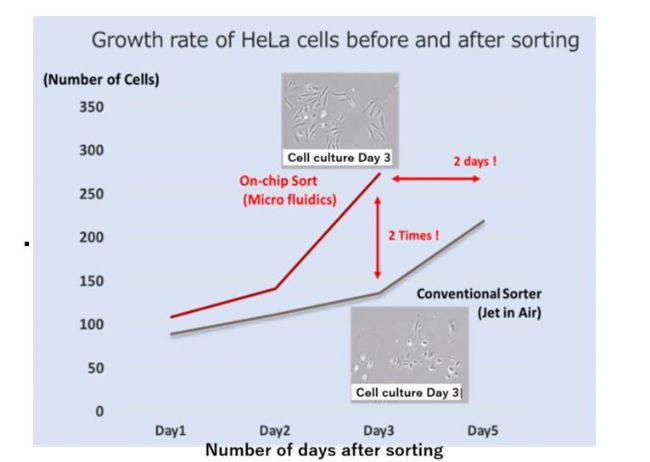 图 1 分选后HeLa细胞的生长曲线。(照片拍摄于第三天)
图 1 分选后HeLa细胞的生长曲线。(照片拍摄于第三天)
利用On-chip Sort 无损伤流式细胞分选仪分选的细胞在分选后第二天开始生长,并且在第三天细胞数量翻倍增长。另一方面,利用传统细胞分选仪分选的细胞在分选后第三天才开始生长,与On-chip Sort 无损伤流式细胞分选仪相比,分选后的细胞生长较慢。
02. 分选对细胞形态的影响
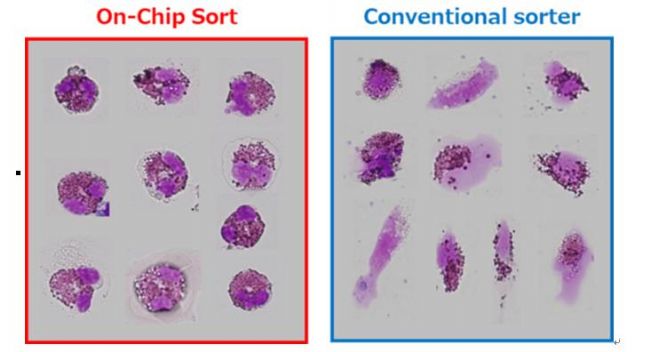
图 2 用苏木精和伊红染色的外周血嗜酸性粒细胞的形态学图。分别利用On-chip Sort 无损伤流式细胞分选仪(左)和传统细胞分选仪(右)分选后通过细胞涂片进行固定。
明显观察到分选后细胞形态上的变化。利用On-chip Sort 无损伤流式细胞分选仪分选后的嗜酸性粒细胞基本完好无损,细胞结构保持不变。但是,利用传统细胞分选仪分选后的细胞出现破碎的情况。据推测,传统的细胞分选仪在分选时可能会导致细胞膜受损,所以分选后出现细胞破碎。
03. 分选对基因表达的影响
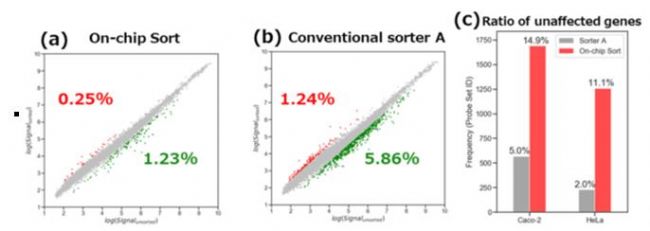 图 3 比较利用On-chip Sort 无损伤流式细胞分选仪(3a)和传统细胞分选仪A(3b)分选后的HeLa细胞和未分选的HeLa细胞的基因表达水平变化。红点代表上调基因,绿点代表下调基因。百分比数字表示所有基因上调(红色)和下调(绿色)的百分比。(3c)表示通过On-chip Sort 无损伤流式细胞分选仪和传统细胞分选仪A分选后Caco-2细胞和HeLa细胞未受影响的基因表达的直方图。百分比数字表示所有分类特性(细胞凋亡、细胞黏附、细胞周期等)的未受影响基因占总基因的比例。表达变化的比率被定义为分选细胞的信号强度/未分化细胞的信号强度。
图 3 比较利用On-chip Sort 无损伤流式细胞分选仪(3a)和传统细胞分选仪A(3b)分选后的HeLa细胞和未分选的HeLa细胞的基因表达水平变化。红点代表上调基因,绿点代表下调基因。百分比数字表示所有基因上调(红色)和下调(绿色)的百分比。(3c)表示通过On-chip Sort 无损伤流式细胞分选仪和传统细胞分选仪A分选后Caco-2细胞和HeLa细胞未受影响的基因表达的直方图。百分比数字表示所有分类特性(细胞凋亡、细胞黏附、细胞周期等)的未受影响基因占总基因的比例。表达变化的比率被定义为分选细胞的信号强度/未分化细胞的信号强度。
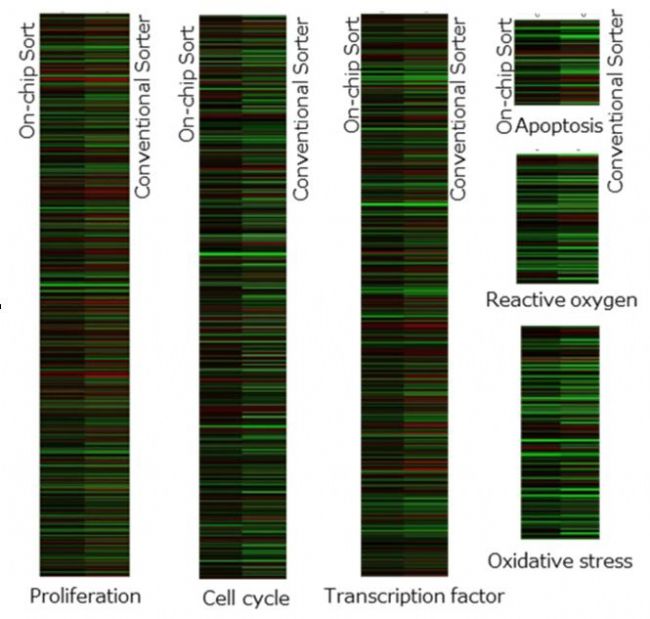 图 4 具有已确认差异的分类特性的基因表达模式。在每个属性中,左列和右列分别表示On-chip Sort 无损伤流式细胞分选仪和传统细胞分选仪的数据。黑色表示基因表达没有变化,红色表示上调,绿色表示下调。
图 4 具有已确认差异的分类特性的基因表达模式。在每个属性中,左列和右列分别表示On-chip Sort 无损伤流式细胞分选仪和传统细胞分选仪的数据。黑色表示基因表达没有变化,红色表示上调,绿色表示下调。
图3a、3b和3c显示,与传统细胞分选仪相比,On-chip Sort 无损伤流式细胞分选仪对HeLa细胞分选后基因表达变化较小。并且,基因表达水平上没有变化的基因数量比传统细胞分选仪高3-5倍。图4显示的两种细胞分选仪之间基因表达模式的各种差异支持了图1表示的两种细胞分选仪对细胞生长速率影响的差异这一结果。尽管基因表达分析是在两种类型的细胞分选后30到60分钟内完成的,但是根据分选后的进程不同,结果可能有所不同,总的来说,可以观察到传统细胞分选仪和On-chip Sort 无损伤流式细胞分选仪分选后基因表达的差异。
04. 分选神经元
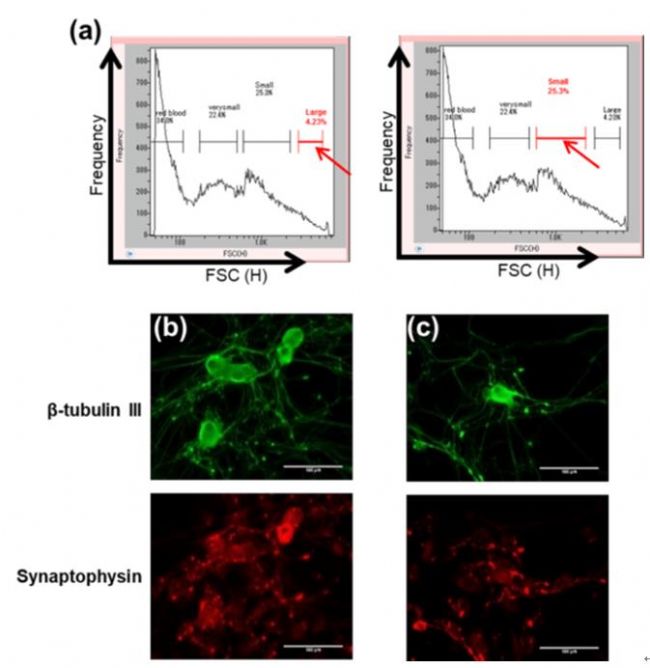 图 5 散点图(5a)显示了利用On-chip Sort 无损伤流式细胞分选仪根据大小从异质DRGs细胞样本中分选的两个单独细胞群(用红色箭头表示,命名为“大”和“小”)的阀门。通过抗-β-微管蛋白III(绿色)和抗突触素(红色)染色,确定(5a)中分离的“大”(5b)和“小”(5c)细胞群中的神经细胞。
图 5 散点图(5a)显示了利用On-chip Sort 无损伤流式细胞分选仪根据大小从异质DRGs细胞样本中分选的两个单独细胞群(用红色箭头表示,命名为“大”和“小”)的阀门。通过抗-β-微管蛋白III(绿色)和抗突触素(红色)染色,确定(5a)中分离的“大”(5b)和“小”(5c)细胞群中的神经细胞。
从10周龄大鼠收集的DRG细胞通过酶处理分离,并在分选前悬浮在神经细胞基础培养基中。根据大小对预处理样品进行分类。从大小分布中观察到四组细胞,其中两组细胞利用On-chip Sort 无损伤流式细胞分选仪分选并培养五天。这两个细胞群都被多聚甲醛固定,并用抗-β-微管蛋白III和抗突触素染色,其中,抗-β-微管蛋白III可以识别神经元中的微管蛋白,抗突触素可以识别负责神经传递的神经元。染色结果证实这两个细胞群都是DRG中的活性神经细胞。因此,这些结果表明,On-chip Sort 无损伤流式细胞分选仪能够按大小分离DRG神经元,同时保持细胞活性。
05. 分选诱导性多能干细胞
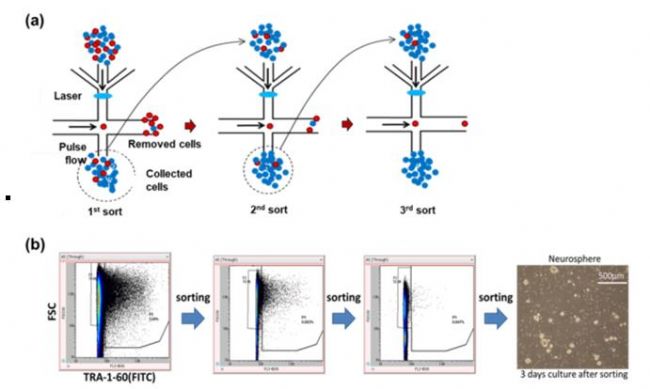 图 6 (6a)多步骤负分选原理。红点是未分化的细胞,蓝点是分化的细胞。(6b)通过多步骤负分选从分化的神经干细胞样品中去除未分化的细胞。
图 6 (6a)多步骤负分选原理。红点是未分化的细胞,蓝点是分化的细胞。(6b)通过多步骤负分选从分化的神经干细胞样品中去除未分化的细胞。
On-chip Sort 无损伤流式细胞分选仪上的多步骤负分选通过加载样品(与少有的未分化细胞群混合的分化细胞)到芯片的样品池中。未分化的细胞(非靶细胞)通过脉冲流的形成而被去除,流入收集池,而分化的细胞(靶细胞)则流入芯片下游的废液池。分化的细胞被回收并重新加载到样品池中进行进一步纯化。重复这个过程直到所有未分化的细胞被去除。图6b显示了含有分化为神经干细胞的细胞的样品中约4%的未分化细胞被去除。用FITC偶联的抗-TRA-1-60荧光标记未分化细胞,荧光信号用于检测。所有未分化的细胞在三次分选后全部被去除,并且分选的分化细胞在培养后表现出良好的细胞活性。
06. 分选细胞-细胞混合物
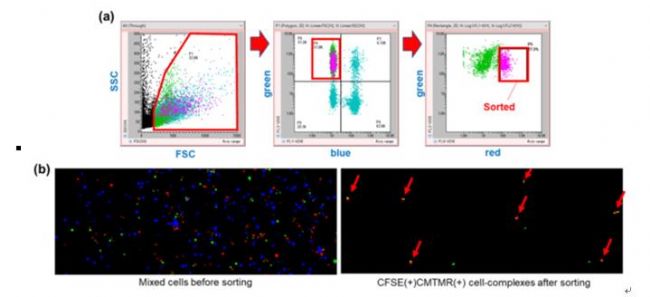 图 7 (7a)异质样品中通过若细胞间相互作用结合在一起的细胞双复合体(绿色和红色细胞)的分类。(7b)通过On-chip Sort 无损伤流式细胞分选仪分选前(左)和分选后(右)的样品。
图 7 (7a)异质样品中通过若细胞间相互作用结合在一起的细胞双复合体(绿色和红色细胞)的分类。(7b)通过On-chip Sort 无损伤流式细胞分选仪分选前(左)和分选后(右)的样品。


