根据《2018年世界阿尔茨海默病报告》(Patterson,2018),全球超过5000万人被诊断患有阿尔茨海默病(AD)或其他形式的痴呆症。医疗总费用估计为1万亿美元。毫无疑问,AD是当今研究的一个重要领域,因为科学家们希望找到一种有效的治疗策略来治疗这种衰弱的疾病。
目前,研究人员正试图利用在许多神经退行性疾病相关肽和蛋白质中观察到的D-氨基酸替换的这一事实(Li,Delaney,Li,2019)。特别是氨基酸淀粉样β(Aβ)的手性反转被认为在AD的病理发展中起着重要作用(Li,et al.,2019)。不幸的是,区分由D-氨基酸取代引起的细微手性差异并非易事。这使得人们对手性化学在疾病进展和治疗中的作用机制知之甚少。

幸运的是,来自威斯康星大学麦迪逊分校药剂学学院李博士和她的团队正在研究一种新方法,以更好地了解手性如何影响aβ片段的自组装/齐聚以及受体识别。这种新方法主要基于质谱测量,李博士团队将这个新方法称为iCAP,在研究中通过OpenSPR™提供的定量的结合动力学数据在iCAP方法的建立中发挥了重要作用,其研究成果发表在最近的Nature Communications 上“Molecular basis for chirality-regulated Aβ self-assembly and receptor recognition revealed by ion mobility-mass spectrometry”.

接下来,我们将给大家展示李博士团队如何通过iCAP研究手性效应,以及OpenSPR如何提供关键的结合动力学数据来研究手性对Aβ受体识别的影响:
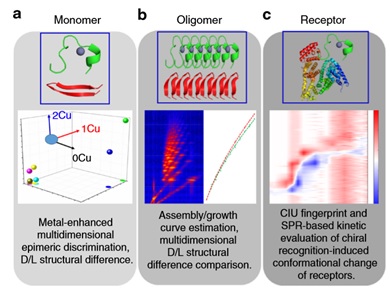
iCAP方法的建立分三步
01
手性Aβ片段单体的鉴别
iCAP的第一步是直接处理淀粉样β(Aβ)单体。目标是区分D和L差向异构体,并对D差向异构体的研究有特别的兴趣。利用行波离子迁移率分离-质谱(TWIMS-MS)技术,通过金属配位放大了两个差向异构体的结构差异,然后利用三维散射碰撞截面(CCS)值进行可视化。由于每一个差向异构体与金属配位能力的不同,D和L差向异构体表现出不同的结合率,其配合物表现出明显的结构差异。这使得Li团队能够研究具有特定手性的β片段单体。
02
手性Aβ片段低聚物的鉴别
Li等人(2019)写到:“AD的特征之一是脑内的细胞外淀粉样斑块沉积,被认为与Aβ自组装/低聚有关”(p.4)。换言之,研究不同的Aβ-表聚物齐聚的方式将有助于深入了解其导致阿尔茨海默病的机制。在iCAP的下一步中,我们使用与第一步相同的手性放大方法来研究Aβ自组装/齐聚反应。通过分析低聚物的CCS值与低聚物数的关系,绘制了低聚物的生长曲线。
由于Aβ的野生型(又名L型)与D 异构型经常共存,李博士团队对几种形式的Aβ肽的混合物的研究尤其感兴趣,以研究它们的交叉手性效应。在这个过程中,她们注意到D-异
构Aβ片段以混合物的形式对自组装/齐聚的手性作用甚至比其自身的手性作用更大。由于Aβ以自然的混合物的形式出现,这是D-异构化Aβ片段可能参与AD进展的重要证据。
03
利用OpenSPR 的LSPR技术研究手性Aβ受体识别
作为iCAP的最后一步,获得Aβ的手性如何影响其与天然受体-四聚甲状腺素(TTR)相互作用的方式对Li研究组是至关重要的。实验中,Li团队用我们的OpenSPR™仪器检测了上述分子间的相互作用(Li研究组成员说:我们选择OpenSPR作为识别手性aβ结合行为的工具,因为OpenSPR™是为各种不同分子相互作用提供深入无标记结合动力学的有力工具。SPR最常见的应用之一是分析和量化蛋白质之间的相互作用),实验过程中,TTR被固定在一个羧基传感器芯片上。将野生型和D-异构化的Aβ的不同片段溶于PBS并注入不同浓度 。每个结合实验重复三次,以获得每个Aβ片段与TTR的平均结合率(Kon)、解离率(Koff)和总的结合亲和力(KD)。
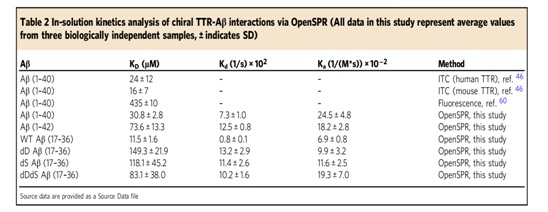
基于SPR的动力学数据结果,Li研究团队发现D-异构化的共异构化Aβ片段的结合亲和力比野生型Aβ片段低8-10倍,解离率高13-15倍。换句话说,D-异构化Aβ片段显著降低了Aβ结合其天然受体的能力。这些OpenSPR结果表明手性在Aβ(17-36)片段受体识别的差异动力学调节的作用 ,其中微摩尔级的结合亲和力的指示Aβ(17-36)片段与TTR的结合弱。并且还利用溶液动力学分析和气相CIU-IM-MS研究了其受体对手性aβ片段识别(包括HSA/BSA/mTTR/TTR )。
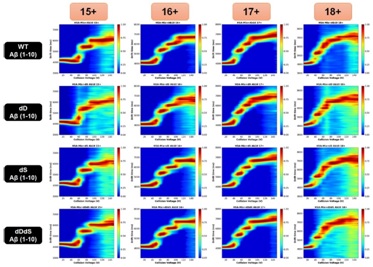
Native CIU-IM-MS provides structural information on HSA-Aβ (1-10) fragment binding interactions.
总结
通过开发iCAP方法,Li研究团队能够对手性如何影响aβ片段的自组装/齐聚以及受体识别提供全面的评估。通过从这个平台获得的大量数据,iCAP有朝一日将有助于设计针对D-异构化和共异构化Aβ片段的Alzheimer病新的治疗方法。该技术理论上也可用于研究类似的手性体系。
由于定量结合动力学对iCAP的有效性起着关键作用,Li研究团队选择了OpenSPR™来获取他们需要的数据。Nicoya通过提供价格合理且易于使用、免维护的OpenSPR,帮助科学家取得成功。李博士是众多使用OpenSPR动力学结合数据在高影响力期刊上发表论文的研究人员之一,如《 Nature Communications》等。

OpenSPR在帕金森疾病研究中的优势
• 多参数检测---Ka、Kd、KD、EC50、蛋白浓度测定;
• 操作简单---模块化提示,1-2小时即可掌控;
• 高精准---检测不受温度、缓冲液折射率影响;
• 低维护---1000-1500元/年;
• 高效率---上样、出结果,一键式分析;


